黄石爱尔眼科医院伦理委员会
审查流程及资料提交说明
一、伦理审查流程
1.确认符合伦理审查条件(项目已在机构初审,由机构流程转伦理流程)
2.秘书受理送审文件
1)受理研究者送审文件。
2)按清单检查其项目是否齐全。
3)在递交信或文件上签署收件日期。
4)收件人签名。
3.缴清伦理审查费用,秘书凭打款凭证安排会议审查或快速审查时间。
4.会议审查或快速审查
- 如审查结果一致为“同意”,主任委员签署批准同意函,在下一次全体会议上通报情况;如审查结果不一致,将在下一次全体会议上讨论。
- 会议审查时间一般不超过2周,快速审查一般不超过7个工作日。
二、伦理送审材料需包含以下内容,具体说明如下:
(一)包含八个文档,分别是材料目录、临床试验申请表(由机构提供)、项目方案简介、组长单位伦理审查批件、伦理递交函、送审文件清单、专业研究团队说明(PI签名并注明日期)、初始审查申请表(PI签名并注明日期)。递交资料前,请严格按照递交文件清单核对材料是否齐全、签字或盖章是否有缺漏、页码是否编制完整、是否按照装订要求装订文件等。资料不齐全或不规范的项目,不予受理。
递交文件清单
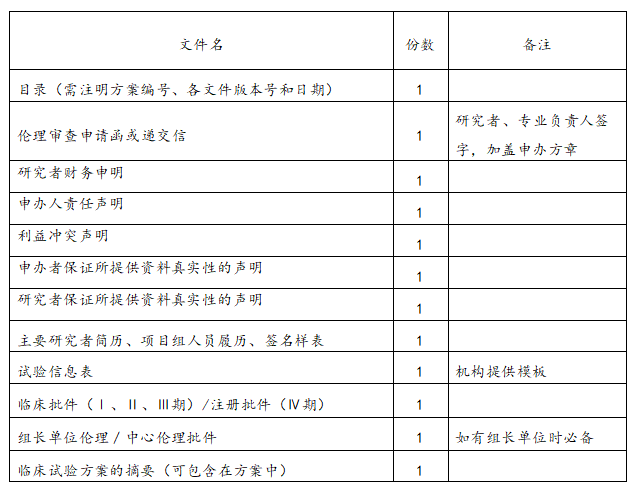
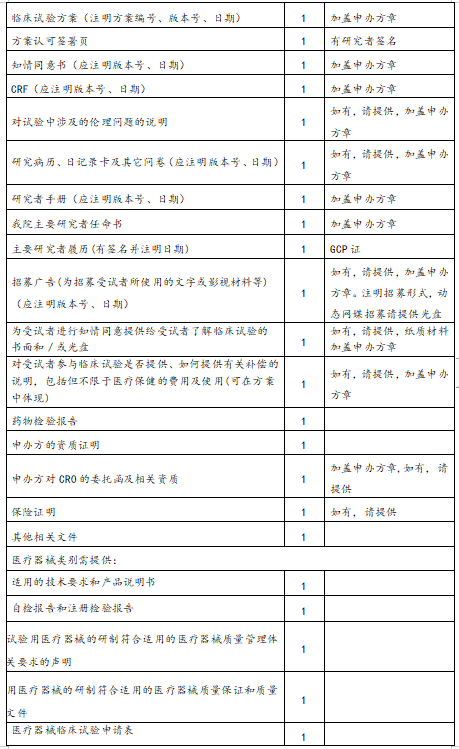

(二)装订要求:
1、按上述顺序装订,并编制连贯页码;
2、使用黑色双孔文件夹装订,装订要求:
按送审文件清单(药物或器械)准备纸质材料一本
(1)A4大小的黑色双孔文件夹;
(2)文件夹侧面需有标签:注明项目名称、试验期别、申办方、CRO(如有)、承担科室、项目负责人等信息(按伦理备案资料标签模板做,附后);
(3)首页为黑色双孔文件夹中的送审文件清单目录(参考文件清单);
(4)黑夹子中的每份文件须有申办方公章、封面章、齐缝章;
(5)申办方提交的企业法人营业执照、组织机构代码证、临床研究委托书 需盖申办方公章;
(6)方案签字页由PI签名并注明日期;
(7)CRO提交的企业法人营业执照、组织机构代码证、临床试验派遣函需盖CRO公章;
(8)CRA需提供盖有公章的本人身份证复印件,并在复印件上标明联系方式。
(三)会议审查前,需提交简装版审查资料9份,A4大小拉杆透明夹装订,内容包括材料目录、项目方案简介、知情同意书、对试验中涉及的伦理问题的说明、专业研究团队说明(PI签名并注明日期)、初始审查申请表(PI签名并注明日期)、招募广告、保险证明、对受试者参与临床试验是否提供、如何提供有关补偿的说明,包括但不限于医疗保健的费用及使用(可在方案中体现)。
(四)提交纸质版材料之前需提交电子版材料
1、以上材料均需同时提交电子版,材料命名方式为“项目+申办方+联络人姓名+联系电话+完整版或上会版资料”;
2、所有电子版打包发送至20676275@qq.com邮箱,发送后请电话通知0714-3268274伦理委员会秘书;
3、注意:请保证电子版资料和纸质版资料的一致性。
(五)准备伦理汇报PPT模板
由项目负责人在会议审查时汇报。(汇报时间5分钟)
1、PPT的基本要求:
(1) 伦理委员会要求,PPT第一张片子请提供国家食品药品监督管理局的药物临床试验的批件的电子版(器械参考提供)。
(2)PPT第二张片子请注明药物注册分类及临床试验分期(器械参考提供)。
(3)汇报时间限时5分钟,PPT页数控制在15张以内,有关试验方案设计与实施内容的占3-4张,试验的风险与受益2-3张,知情同意书告知的信息及知情同意的过程占2-3张,受试者的医疗和保护占1-2张
(4)报告时重点说明:试验中涉及的有关伦理问题,如受试者参加试验的风险与受益,对受试者是否提供、如何提供补偿,包括但不限于医疗保健的费用及使用,对于高风险项目,如安慰剂、Ⅰ类新药等,可汇报研究者方案讨论会时的有关意见。
(6)汇报时侧重报告与伦理相关的内容,试验方案简单介绍即可
2、申办方项目人员将PPT制做好后及时发给主要研究者熟悉,并相互讨论修改;
3、上会PPT完善后请发送一份到伦理委员会邮箱20676275@qq.com,进行审核,邮件标题上请注明“XX试验-伦理会PPT”,如不合要求,需尽快修改以免耽误上会审查。

